谢黎炜团队发现低强度脉冲超声在促进骨骼肌再生方面的新应用
骨骼肌占人体总质量的40%,作为运动系统的重要组成部分,参与人体各种身体活动;骨骼肌又是重要的内分泌器官,通过自分泌/旁分泌的方式参与调控人体多种代谢途径,骨骼肌代谢紊乱可能导致胰岛素抵抗、代谢综合征和肥胖等。肌肉质量以及功能对于维持正常的身体活动,保护骨关节,调节体内新陈代谢等均发挥了至关重要的作用。但是许多情况,如代谢紊乱,肌失用,衰老,慢性疾病,肌骨损伤等的患者,都会出现骨骼肌的质量减少和萎缩,最终使肌肉功能衰退。其中肌肉损伤是造成骨骼肌功能障碍的一大常见原因。流行病学调查显示,肌肉损伤占所有运动损伤的10% - 55%,如果没有及时进行肌肉功能的康复,会引起代谢紊乱,机体各项机能逐渐下降、出现机体虚弱、活动能力和平衡能力降低等,容易引发跌倒,骨折等不良后果,严重影响到患者的生活和生活质量。因此,促进骨骼肌损伤后的再生,尤其是中老年人一直是康复医学的主要研究方向之一。

近日,广东省科学院微生物研究所、华南应用微生物国家重点实验室谢黎炜研究员团队联合南方医科大学南方医院康复医学科刘刚主任团队,在 Cellular Signalling期刊上发表了题为:Low-intensity pulsed ultrasound (LIPUS) promotes skeletal muscle regeneration by regulating PGC-1α/AMPK/GLUT4 pathways in satellite cells/myoblasts的研究论文。该研究首次报道了低强度脉冲超声(LIPUS)可通过AMPK代谢通路调控骨骼肌卫星细胞和成肌细胞的活性从而在骨骼肌再生中显示出显著的治疗潜力。该研究的发现为LIPUS在改善损伤后骨骼肌再生方面的应用奠定了理论基础,肯定了使用LIPUS作为严重肌肉损伤的非侵入性治疗选择。
骨骼肌损伤后的再生是一个精准调节的生物学过程,需要有序调用一系列细胞和分子。其中,肌卫星细胞(Muscle Satellite Cells,MuSCs)作为骨骼肌的原代成体干细胞,在骨骼肌损伤再生过程中发挥着至关重要的作用。这些细胞位于骨骼肌肌膜和基板之间,促进肌肉的生长、修复和再生。在未损伤的肌肉中,卫星细胞通常处于静息状态,当受到轻微的(如拉伸、拉伸或运动)或是严重的肌肉损伤(如创伤或退行性肌肉疾病)时,改变的生态位信号激活卫星细胞并促进其肌原性活动,通过增殖,分化,融合成肌管,参与到肌肉修复的过程中。卫星细胞的缺陷会导致再生障碍和过早老化,进而会导致肌肉萎缩或运动功能的下降。低强度脉冲超声(Low intensity pulsed ultrasound,LIPUS)作为新兴的康复物理因子治疗手段,具有非侵入性、精确、靶向、和易于使用等特性。它能够靶向身体的固定部位,引起组织中的热和非热生理效应,提供必要的机械刺激从而达到治疗作用。目前LIPUS的临床应用主要集中在骨折愈合,骨关节炎等治疗方向,在骨骼肌方面的临床应用较少。尽管先前的研究确实证明了LIPUS在肌肉萎缩疾病中表现出较好的治疗作用,但肌卫星细胞在LIPUS积极效果中的具体贡献仍然是一个未知。本研究通过构建CTX肌肉损伤模型,在损伤的早期经过LIPUS的干预后,结果表明LIPUS治疗显著增加卫星细胞群和新形成肌纤维的数量和大小,同时降低急性损伤阶段的纤维化水平。并且损伤后30天观察到持续的益处,表明早期LIPUS干预通过促进卫星细胞增殖和分化来促进长期恢复。这些结果显示LIPUS在组织重塑和提高再生效率方面的潜能。该研究证明了LIPUS在骨骼肌损伤后再生中显著的治疗潜力,主要是通过增强卫星细胞和成肌细胞的活性来介导的。
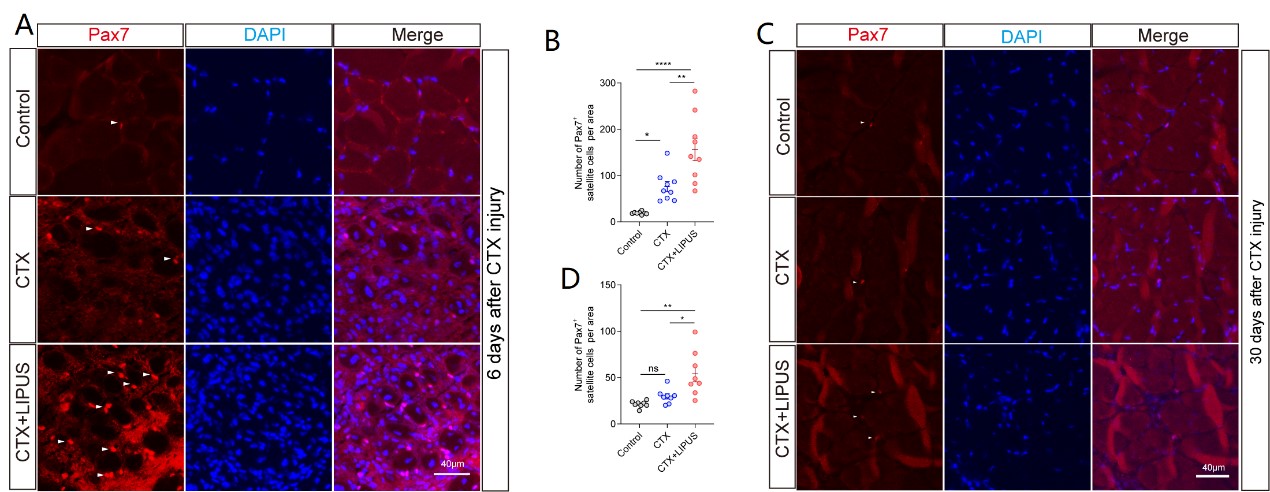
图1: LIPUS增强并维持卫星细胞的再生能力
骨骼肌再生的过程复杂,涉及多种细胞类型和分子机制。肌肉再生是一个能量密集的过程,静息的卫星细胞的激活表现出更高的代谢需求和增强的线粒体活性,这一过程高度依赖于能量代谢和细胞内信号传导途径的精确调控。作为细胞能量储备的关键指标,AMPK在细胞能量中起着核心作用,AMPK的激活可以触发一系列代谢调节机制,包括促进GLUT4的膜转位促进葡萄糖摄取、激活PGC1α促进线粒体生物生成,为卫星细胞的增殖和分化过程提供充足的能量供应。考虑到卫星细胞的关键作用和它们在再生过程中的能量需求,调整它们的能量水平可能是一种新的肌肉修复方法。虽然最近的研究将LIPUS与干细胞/祖细胞联系起来,但其对肌肉干细胞的影响及其相关机制在很大程度上仍未被探索。因此,该研究假设LIPUS对肌卫星细胞的调节可能涉及到AMPK/GLUT4/PGC1α能量通路。该研究体内实验结果表明,LIPUS可以通过激活AMPK,诱导Glut4和PGC-1α的表达,促进了线粒体生物发生,这可能为卫星细胞的增殖和分化提供充足的能量供应,有利于骨骼肌的再生。体外研究结果显示LIPUS治疗明显加速C2C12成肌细胞分化,同样的AMPK磷酸化增加,导致了Glut4和PGC1α表达上调,并且提高了细胞的葡萄糖摄取能力和线粒体生物发生,最终提高细胞能量利用率。并且AMPK被抑制后,逆转了LIPUS对成肌细胞分化的促进作用。
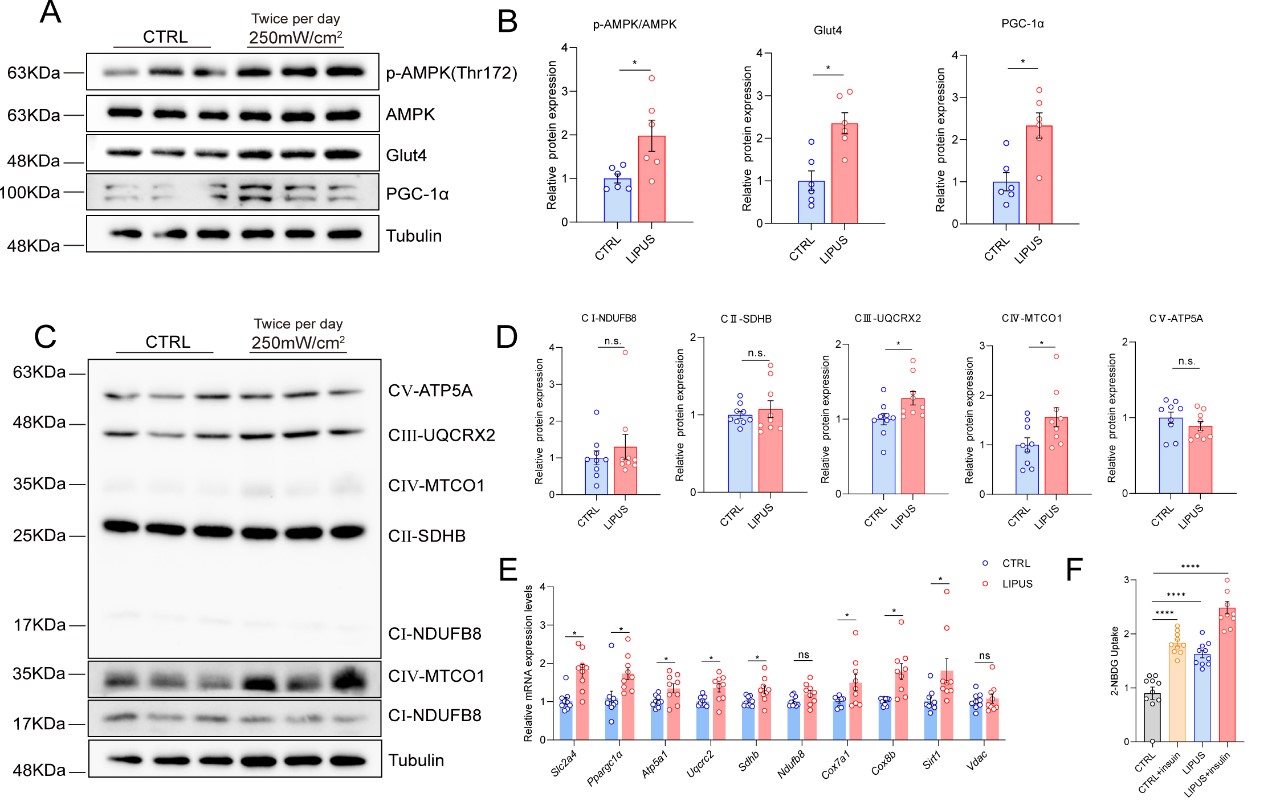
图2:LIPUS通过激活AMPK通路促进C2C12成肌细胞分化
该研究通过细胞和动物CTX肌肉损伤模型,研究了LIPUS对卫星细胞和骨骼肌再生的影响,首次报道了LIPUS对骨骼肌损伤后再生中的积极作用,这与肌卫星细胞和成肌细胞活性的调节密不可分。此外,体外研究证实了LIPUS对卫星细胞的调节作用可能归因于其增强细胞能量代谢的能力。
总而言之,该研究发现LIPUS参与了肌肉再生过程中对肌卫星细胞活性的调节,为LIPUS的作用机制提供了重要的见解,为其在改善损伤后骨骼肌再生方面的应用奠定了理论基础,并为骨骼肌损伤和相关疾病的治疗策略提供了新靶点和新思路。
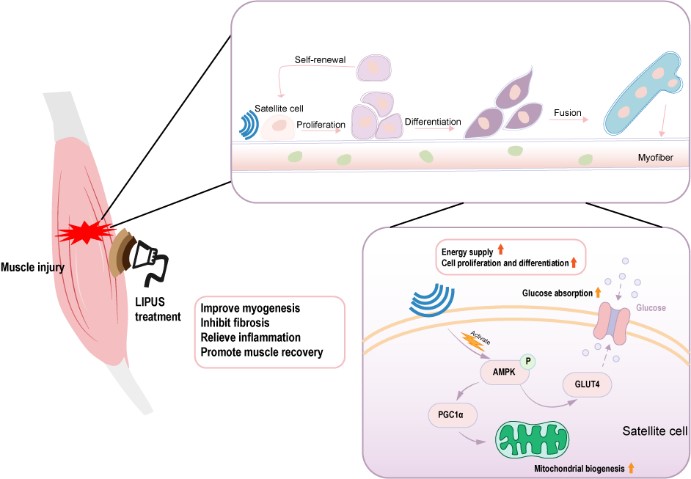
图3: LIPUS治疗肌肉损伤机制图
该研究的通讯作者是广东省科学院微生物研究所,华南应用微生物国家重点实验室,谢黎炜研究员,第一作者段惠敏是谢黎炜研究员与南方医院康复科联合培养的硕士研究生,共同第一作者陈淑洁是谢黎炜研究员的博士后和麦旭东是南方医科大学珠江医院联合培养的博士研究生。本文的共同通讯作者南方医科大学南方医院康复科刘刚主任参与课题的设计和讨论。
附件下载: